

「禁忌を含む注意事項等情報」等はD.I.をご参照ください。
第Ⅲ相臨床試験 ①(プラセボ対照二重盲検比較試験[検証試験])
1試験概要
デザイン |
プラセボ対照無作為化二重盲検比較検証試験(並行群間比較法) |
|---|---|
| 目的 | 2 型糖尿病患者を対象に、ルセフィ2.5mg またはプラセボを24 週間投与し、有効性(プラセボに対する優越性)および安全性について、プラセボと比較検証する。 |
| 対象 | 食事・運動療法にて血糖コントロール不十分な2型糖尿病患者158例
|
| 方法 |
ルセフィ2.5mg群、プラセボ群に無作為に割り付け、それぞれの治験薬を1日1回、朝食前に24週間経口投与した。 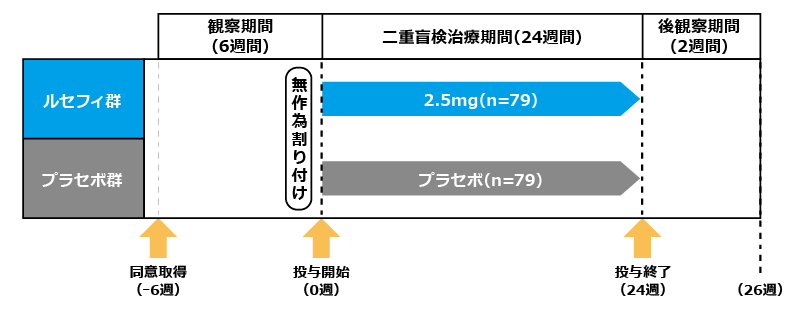
|
| 評価方法 | 来院ごと(投与0週、2週、4週、8週、12週、16週、20週、24週)にHbA1c、空腹時血糖値(朝食前)、体重を測定した。また、投与0週と12週および24週(または中止時)に腹周囲の測定および食事負荷試験を実施し、食事開始前、開始後30分、1時間、2時間に採血し、血糖値およびインスリンを測定した。 |
| 主要評価項目 | HbA1c (HbA1c はNGSP値で表記) |
| 副次的評価項目 | 血糖値、インスリン、グルカゴン、血中CPR、インタクトプロインスリン、グリコアルブミン、体重、腹周囲、尿糖定量、HOMA-R、HOMA-β |
| 安全性評価項目 | 有害事象(臨床検査値、バイタルサイン、12誘導心電図を含む)の内容および発現頻度 |
| 解析計画 | 有効性の解析対象はFASを主要な解析対象集団、PPS を副次的な解析対象集団、安全性の解析対象は安全性解析対象集団とした。
|
- 社内資料(臨床試験HbA1c[NGSP値]再解析結果)
- 承認時評価資料(プラセボ対照二重盲検比較試験:検証試験)
- Seino Y et al.: Curr Med Res Opin. 2014; 30: 1245-1255.
- [利益相反]本試験は、大正製薬株式会社の支援によって行われました。
生方路人、坂井荘一、寒川能成は、大正製薬株式会社の社員です。
第Ⅲ相臨床試験 ①(プラセボ対照二重盲検比較試験[検証試験])
2HbA1cの改善効果
最終評価時におけるHbA1cのベースラインからの変化量は、ルセフィ2.5mg群で−0.63%であり、プラセボ群の0.13%に比べて有意な低下が認められ、ルセフィ2.5mg群のプラセボ群に対する優越性が検証された。ルセフィ2.5mg群において、投与2週からプラセボ群に比べてHbA1cの有意な低下が認められ、24週まで維持された。
■最終評価時におけるベースラインからのHbA1c変化量
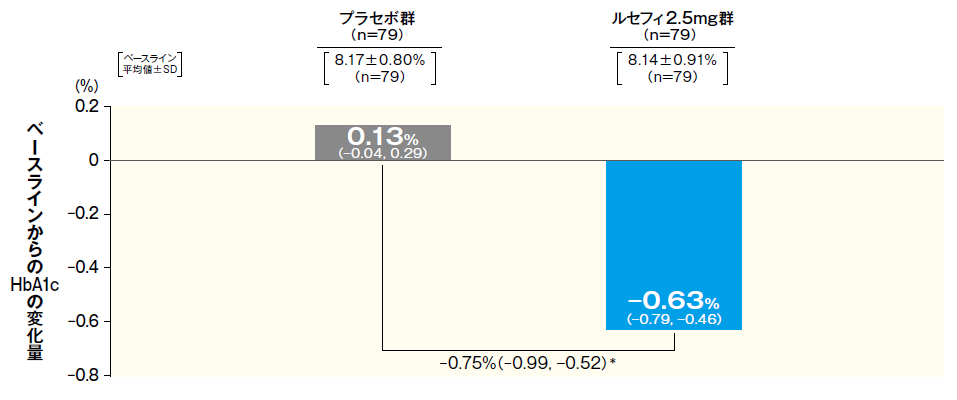
- 最終評価時:中止、脱落例などは、最終観察時点の測定値を解析
- FAS 最小二乗平均値(95% CI)
- *:p < 0.001(vs. プラセボ群)、治療期開始時(ベースライン)の値を共変量とした共分散分析
■ベースラインからのHbA1c変化量の推移
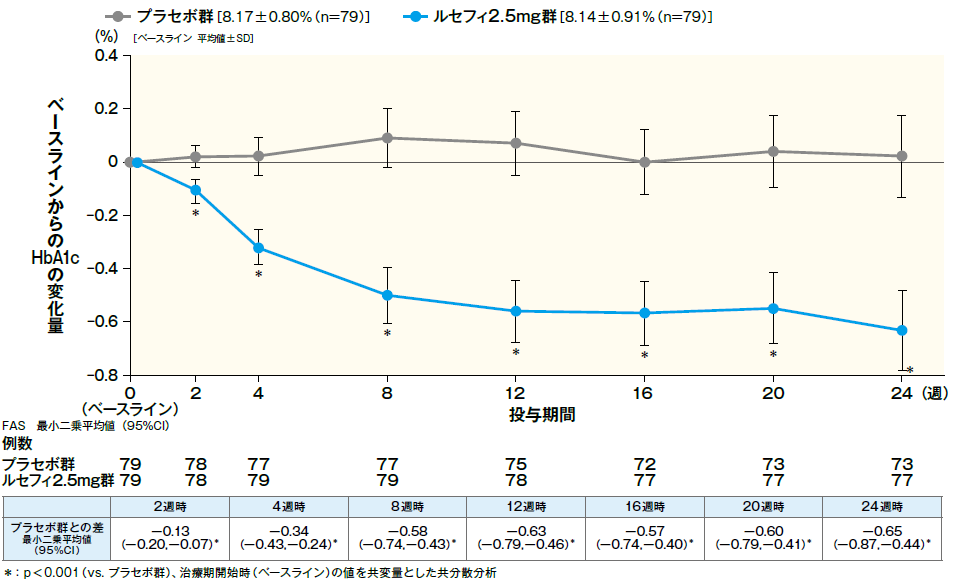
第Ⅲ相臨床試験 ①(プラセボ対照二重盲検比較試験[検証試験])
3空腹時血糖値の改善効果
最終評価時における空腹時血糖値のベースラインからの変化量は、ルセフィ2.5mg群で−28.3mg/dLであり、プラセボ群の−0.8mg/dLに比べて、有意な低下が認められた。また、ルセフィ2.5mg群において、投与2週からプラセボ群に比べて空腹時血糖値の有意な低下が認められ、24 週まで維持された。
■最終評価時におけるベースラインからの空腹時血糖値変化量およびベースラインからの空腹時血糖値変化量の推移
最終評価時におけるベースラインからの
空腹時血糖値変化量
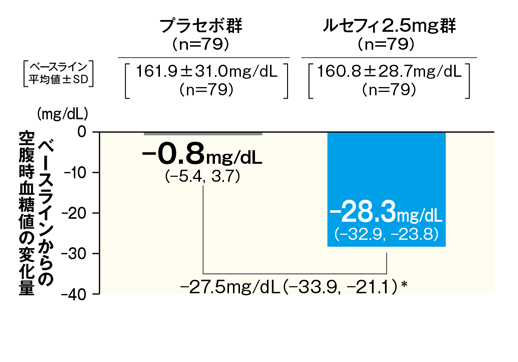
- FAS 最小二乗平均値(95% CI)
- *:p < 0.001(vs. プラセボ群)、治療期開始時(ベースライン)の値を共変量とした共分散分析
- 最終評価時:中止、脱落例などは、最終観察時点の測定値を解析
ベースラインからの
空腹時血糖値変化量の推移
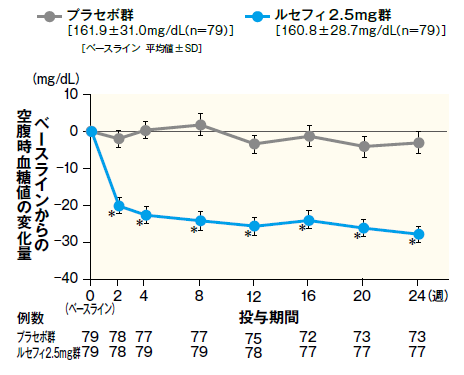
- FAS 平均値 ± SE
- *:p < 0.001(vs.プラセボ群)、治療期開始時(ベースライン)の値を共変量とした共分散分析
第Ⅲ相臨床試験 ①(プラセボ対照二重盲検比較試験[検証試験])
4食後2時間血糖値の改善効果
最終評価時における食後2時間血糖値のベースラインからの変化量は、ルセフィ2.5mg群で−55.8mg/dLであり、プラセボ群の1.1mg/dLに比べて、有意な低下が認められた。
■最終評価時におけるベースラインからの食後2時間血糖値変化量
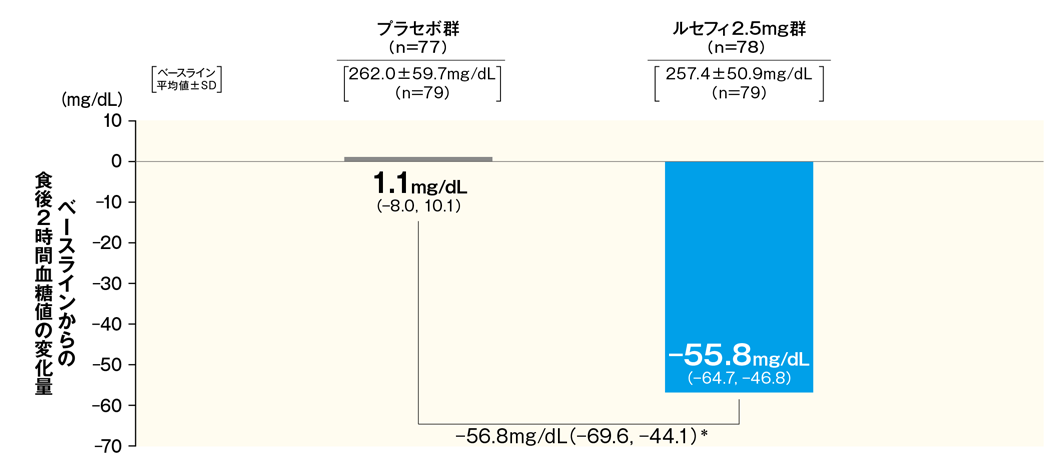
- FAS 最小二乗平均値(95% CI)
- *:p < 0.001(vs. プラセボ群)、治療期開始時(ベースライン)の値を共変量とした共分散分析
- 最終評価時:中止、脱落例などは、最終観察時点の測定値を解析
第Ⅲ相臨床試験 ①(プラセボ対照二重盲検比較試験[検証試験])
5インスリン値に対する影響(参考情報)
最終評価時におけるベースラインからの空腹時インスリン値変化量は2.5mg群で−1.88μU/mLであった。また、最終評価時におけるベースラインからの食後2時間インスリン値変化量は2.5mg群で−6.01μU/mLであった。
■最終評価時におけるベースラインからの空腹時インスリン値変化量

- FAS 最小二乗平均値(95% CI)
- *:p < 0.001(vs. プラセボ群)、2標本t検定
- 最終評価時:中止、脱落例などは、最終観察時点の測定値を解析
■最終評価時におけるベースラインからの食後2時間インスリン値変化量
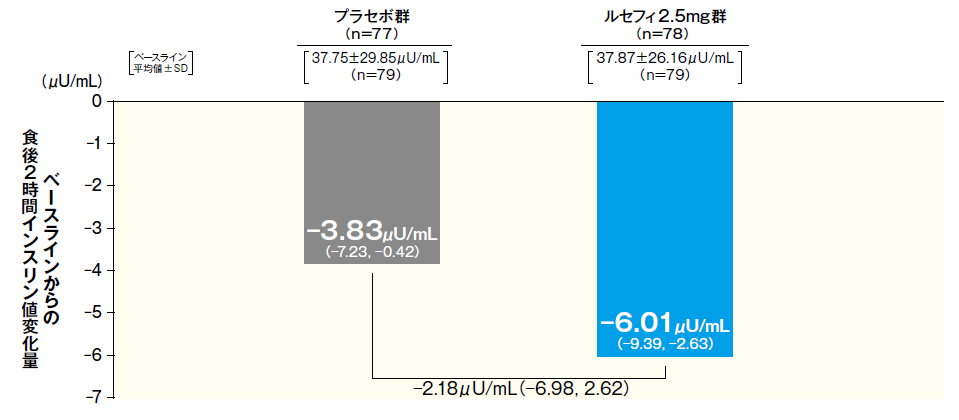
- FAS 最小二乗平均値(95% CI) 2標本t検定
- 最終評価時:中止、脱落例などは、最終観察時点の測定値を解析
第Ⅲ相臨床試験 ①(プラセボ対照二重盲検比較試験[検証試験])
6体重に対する影響(参考情報)
最終評価時における体重のベースラインからの変化量は、ルセフィ2.5mg群で−2.70kgであり、変化量は以下のように推移した。
■最終評価時におけるベースラインからの体重変化量およびベースラインからの体重変化量の推移
最終評価時におけるベースラインからの体重変化量
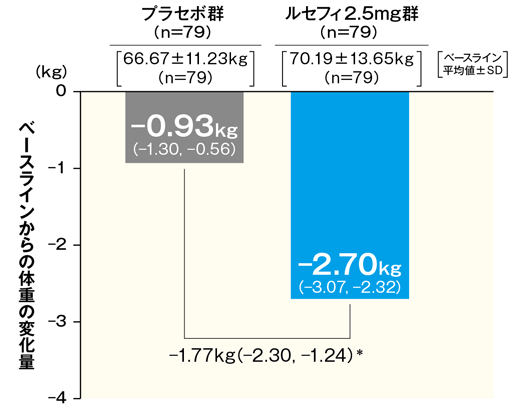
- FAS 最小二乗平均値(95% CI)
- *:p <0.001(vs. プラセボ群)、2標本t検定
- 最終評価時:中止、脱落例などは、最終観察時点の測定値を解析
ベースラインからの体重変化量の推移
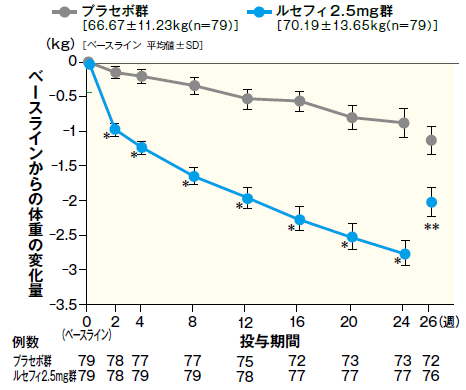
- FAS 平均値 ± SE
- *:p < 0.001、**:p < 0.05(vs. プラセボ群)、2 標本t検定
- 8.重要な基本的注意(抜粋)
- 8.7 本剤投与による体重減少が報告されているため、過度の体重減少に注意すること。
第Ⅲ相臨床試験 ①(プラセボ対照二重盲検比較試験[検証試験])
7腹周囲に対する影響(参考情報)
最終評価時における腹周囲のベースラインからの変化量は、ルセフィ2.5mg群で−2.17cmであった。
■最終評価時におけるベースラインからの腹周囲変化量
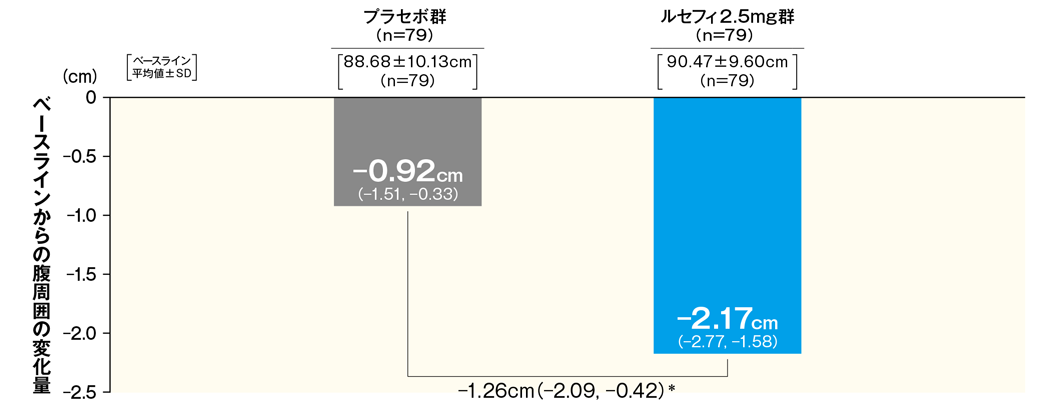
- FAS 最小二乗平均値(95%CI)
- *:p < 0.05(vs.プラセボ群)、2標本t検定
- 最終評価時:中止、脱落例などは、最終観察時点の測定値を解析
第Ⅲ相臨床試験 ①(プラセボ対照二重盲検比較試験[検証試験])
8安全性
本試験の副作用の発現率は、ルセフィ2.5mg 群およびプラセボ群でそれぞれ7.6%(6/79 例)および2.5%(2/79 例)であった。ルセフィ2.5mg群における副作用は、頻尿2 例(2.5 %)、遊離脂肪酸増加1 例(1.3%)、血中ケトン体増加1例(1.3%)、低血糖症1例(1.3%)、多尿1例(1.3%)、陰部そう痒症1例(1.3%)であった。またプラセボ群における副作用は、便秘1 例(1.3%)、背部痛1 例(1.3%)、傾眠1 例(1.3%)であった。なお、本試験において重篤な副作用、投与中止に至った副作用および死亡例は認められなかった。






